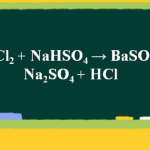Cùng mình tìm hiểu ” BaCO3 là gì? Tìm hiểu BaCO3 có kết tủa không” với chia sẽ dưới đây hi vọng sẽ giúp bạn đọc hiểu khái quát về thông tin trên.
Nội dung
BaCO3 là gì?
BaCO3 là công thức hóa học của Bari Cacbonat, một hợp chất hóa học. Bari Cacbonat là một muối của bari (Ba) và cacbonat (CO3), có công thức hóa học chính xác là BaCO3.
Nó là một hợp chất dạng tinh thể màu trắng và có nhiều ứng dụng trong công nghiệp, như đã được mô tả trong câu trước.

BaCO3 có kết tủa không?
Bari Cacbonat (BaCO3) có khả năng tạo kết tủa màu trắng khi tác dụng với các chất tương ứng.
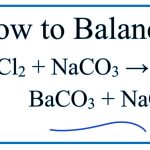
Trong ví dụ bạn đã đưa ra, khi BaCO3 phản ứng với Na2CO3 (natri cacbonat) và BaCl2 (bari clorua), nó tạo ra kết tủa màu trắng (BaCO3)↓.
Điều này là một tính chất quan trọng của Bari Cacbonat và nó được sử dụng trong nhiều ứng dụng trong công nghiệp và phân tích hóa học để tách các chất ra khỏi dung dịch dựa trên sự kết tủa của nó.
Điều chế BaCO3
Có một số phương pháp điều chế Bari Cacbonat (BaCO3) trong công nghiệp, và bạn đã liệt kê một số phản ứng quan trọng để điều chế nó. Dưới đây là mô tả chi tiết về các phản ứng này:
-
Phản ứng với Kali Cacbonat (K2CO3):
- Phương trình phản ứng: K2CO3 + BaS ⟶ K2S + BaCO3
- Kết quả: Khi kali cacbonat tác dụng với bari sulfua, sẽ xuất hiện kết tủa màu trắng của bari cacbonat (BaCO3) trong dung dịch.
-
Phản ứng với Natri Cacbonat (Na2CO3):
- Phương trình phản ứng: Na2CO3 + BaS → NaS + BaCO3
- Kết quả: Khi natri cacbonat tác dụng với bari sulfua, cũng sẽ tạo ra kết tủa màu trắng của bari cacbonat (BaCO3) trong dung dịch.
-
Phản ứng với Canxi Hydroxit (Ca(OH)2):
- Phương trình phản ứng: Ca(OH)2 + Ba(HCO3)2 ⟶ CaCO3 + 2H2O + BaCO3
- Kết quả: Khi canxi hydroxit tác dụng với bari bicarbonate, sẽ tạo ra kết tủa bari cacbonat (BaCO3) cùng với canxi cacbonat và nước.
-
Phản ứng với Amoni Cacbonat ((NH4)2CO3):
- Phương trình phản ứng: (NH4)2CO3 + BaCl2 ⟶ 2NH4Cl + BaCO3
- Kết quả: Khi amoni cacbonat tác dụng với bari clorua, sẽ tạo ra kết tủa màu trắng của bari cacbonat (BaCO3) cùng với amoni clorua.
-
Phản ứng với Kali Cacbonat và Bari Clorua:
- Phương trình phản ứng: BaCl2 + K2CO3 ⟶ 2KCl + BaCO3
- Kết quả: Khi bari clorua tác dụng với kali cacbonat, sẽ tạo ra kết tủa màu trắng của bari cacbonat (BaCO3) cùng với kali clorua.
Các phản ứng này cho phép điều chế Bari Cacbonat trong công nghiệp từ các nguồn nguyên liệu chứa bari như bari sulfua hoặc bari clorua. Kết tủa màu trắng của Bari Cacbonat thường là dấu hiệu rõ ràng cho việc điều chế thành công.
Tính chất lý hóa đặc trưng của BaCO3
Bari cacbonat là tinh thể màu trắng, không mùi.
Nó tan tốt trong axit như axit clohydric (HCl) để tạo thành muối bari tan (ví dụ: bari clorua) cùng với khí CO2 và nước: BaCO3 + 2 HCl → BaCl2 + CO2 + H2O.
Bari cacbonat không tan trong etanol.
Khối lượng mol của BaCO3 là 197,34 g/mol.
Khối lượng riêng của BaCO3 là 4,286 g/cm³.
Nhiệt độ nóng chảy của BaCO3 là 811 °C, và nhiệt độ sôi là 1.450 °C.
Độ hòa tan của BaCO3 trong nước là 16 mg/L ở 8,8°C, 22 mg/L ở 18°C, 24 mg/L ở 20°C, và 24 mg/L ở 24,2°C.
Phản ứng hoá học BaCO3 H2SO4
Phương trình phản ứng BaCO3 H2SO4
BaCO3 + H2SO4 → H2O + CO2↑ + BaSO4↓
Tính chất hoá học khi phản ứng
Trong quá trình phản ứng của hợp chất trên mang tính chất hóa học của muối
Hướng dẫn
Cho BaCO3 tác dụng với dung dịch H2SO4
Ứng dụng của BaCO3

Bari Cacbonat (BaCO3) có nhiều ứng dụng quan trọng trong các ngành công nghiệp khác nhau:
- Công nghệ làm gốm sứ: Bari Cacbonat thường được sử dụng trong công nghệ làm gốm sứ để cung cấp màu sắc và tính chất cơ học cho sản phẩm. Nó có khả năng làm cho một số màu sắc độc đáo mà không thể dễ dàng đạt được bằng cách sử dụng các phương tiện khác.
- Chất trợ chảy và làm kết dính: Bari Cacbonat thường được sử dụng như một chất trợ chảy trong sản xuất gốm sứ và gạch. Nó cũng có khả năng làm kết dính và kết tinh các thành phần khác trong quá trình sản xuất gốm sứ.
- Sản xuất thuốc diệt chuột: Bari Cacbonat cũng được sử dụng trong sản xuất thuốc diệt chuột. Nó có độc tính đối với chuột và thường được sử dụng để chế tạo các sản phẩm chứa chất diệt chuột.
- Vật liệu từ tính: Bari Cacbonat cũng có ứng dụng trong sản xuất vật liệu từ tính, như từ tính lưu điện và từ tính cứng. Nó có thể được sử dụng để tạo ra từ tính mạnh và ổn định.
- Công nghiệp thép: Trong công nghiệp thép, Bari Cacbonat có thể được sử dụng trong các quá trình liên quan đến sản xuất và xử lý thép.
- Các ứng dụng khác: Bari Cacbonat còn được sử dụng trong các lĩnh vực khác như điện tử và trong các thuốc thử và phân tích hóa học.
Từ những ứng dụng này, có thể thấy rằng Bari Cacbonat có vai trò quan trọng trong nhiều ngành công nghiệp và có nhiều ứng dụng đa dạng.
Tính chất nguy hiểm của BaCO3
BaCO3 là thành phần gây ngộ độc mãn tính chủ yếu tích lũy trong xương. Ngộ độc cấp tính nặng sẽ gây ra các biểu hiện về tiêu hóa, phản xạ gân, co giật, liệt cơ.
Nồng độ tối đa của 0.5mg/m3.
Vì vậy, khi sử dụng cần có biện pháp phòng ngừa.
Ví dụ liên quan đến BaCO3
Câu 1: Muối nào sau đây không bị nhiệt phân hủy?
A. BaCO3.
B. Na2CO3.
C. KNO3.
D. KClO3.
Đáp án B
Câu 2. Dung dịch chất nào sau đây tác dụng với dung dịch Ba(OH)2 tạo ra kết tủa?
A. NaCl
B. Na2CO3
C. KCl
D. KNO3
Đáp án B
Dung dịch tác dụng với dung dịch Ba(OH)2 tạo ra kết tủa là Na2CO3
Phương trình phản ứng minh họa
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3
Câu 3. Cho 19,2 gam hỗn hợp muối cacbonat của kim loại hóa trị I và muối cacbonat của kim loại hóa trị II tác dụng với dung dịch HCl dư, thu được 4,48 lít một chất khí (đktc). Tính khối lượng muối tạo ra trong dung dịch.
A. 21,40 gam
B. 42,80 gam
C. 26,75 gam
D. 10,70 gam
Đáp án A
Gọi công thức hai muối cacbonat là M2CO3 và M’CO3
M2CO3 + 2HCl → 2MCl + CO2 + H2O
M’CO3 + 2HCl → M’Cl2 + CO2 + H2O
Áp dụng phương pháp tăng giảm khối lượng:
1 mol muối cacbonnat tạo thành muối clorua ⇒ khối lượng tăng.
35,5 .2 – 60 = 11 (gam) ⇒ nCO2 = nmuối cacbonat = 0,2(mol)
⇒ mmuối clorua = mmuối cacbonlat + 0,2.11 = 19,2 + 2,2 = 21,4 (gam)
Mong rằng qua bài viết này các bạn có thể học tập tốt hơn môn Hóa học.