Phương trình chuyển đổi NH3 ra NH4Cl được các nhà khoa học mô tả là NH3 + HCl → NH4Cl. Phương trình hóa học trên mô tả phản ứng hóa học giữa amoniac (NH3) và axit clohydric (HCl) tạo thành muối amoni clorua (NH4Cl). Đây là một phản ứng axit-bazơ, trong đó NH3 đóng vai trò là bazơ và HCl đóng vai trò là axit. Vậy bản chất của các chất tham gia phản ứng chuyển đổi NH3 ra NH4Cl là gì? Hiện tượng khói trắng khi NH3 tác dụng với HCl là do đâu? Tất cả sẽ được mình giải đáp chi tiết qua bài viết dưới đây.
Nội dung
Phương trình chuyển đổi NH3 ra NH4Cl
Khi NH3 và HCl phản ứng với nhau, hai chất này tạo thành muối amoni (NH4Cl). Quá trình xảy ra phản ứng chuyển đổi từ NH3 sang NH4Cl có thể được mô tả như sau:
NH3 + HCl → NH4Cl
Quá trình diễn ra được nhiều nghiên cứu mô tả như sau:
- Khi NH3 và HCl tiếp xúc với nhau, chúng sẽ tạo ra các ion NH3 phân ly thành ion amoni (NH4+) và ion hydroxit (OH-). Trong khi đó, HCl sẽ phân ly thành ion hydro (H+) và ion clorua (Cl-).
- Sau khi các ion trái dấu hút nhau và kết hợp để tạo thành muối amoni clorua (NH4Cl), ion NH4+ kết hợp với ion Cl- tạo thành NH4Cl.
- Phản ứng này xảy ra nhanh chóng và hoàn toàn sảy ra ở điều kiện nhiệt độ phòng.
Đây là phản ứng trao đổi ion trong đó nhóm hydro của axit HCl được thay thế bằng nhóm amoni NH4+ của NH3. Sản phẩm muối amoni có thể tồn tại dưới dạng dung dịch hoặc tinh thể rắn.
Bản chất của các chất tham gia phản ứng chuyển đổi NH3 ra NH4Cl

Amoniac (NH3)
NH3 là một hợp chất có tính kiềm yếu, được cấu tạo từ 1 nguyên tử N liên kết với 3 nguyên tử H bằng liên kết cộng hóa trị ba. Phân tử amoniac có cấu trúc tứ diện, với nguyên tử N ở tâm và 3 nguyên tử H ở các góc. Do có cặp electron tự do trên nguyên tử N, amoniac có khả năng nhận proton (H+) từ axit để tạo thành muối amoni.
Axit clohydric (HCl)
Axit clohydric là một axit mạnh, được phân ly hoàn toàn trong nước thành ion H+ và ion Cl-. Cấu tạo của HCl bao gồm 1 nguyên tử H liên kết với 1 nguyên tử Cl bằng liên kết cộng hóa trị. Do có liên kết cộng hóa trị phân cực mạnh, HCl dễ dàng phân ly thành ion H+ và ion Cl- trong dung dịch.
Muối amoni clorua (NH4Cl):
NH4Cl là muối khan, và tan tốt trong nước. Cấu tạo của NH4Cl là 1 ion amoni (NH4+) liên kết với 1 ion clorua (Cl-). Do lực hút tĩnh điện giữa các ion trái dấu, NH4Cl tồn tại ở dạng rắn.
Cơ chế phản ứng của các hợp chất trên
- Sự phân ly axit clohydric: HCl sẽ phân ly hoàn toàn trong nước thành ion H+ và ion Cl-. Phương trình phân ly HCl được mô tả như sau: HCl ⇌ H+ + Cl-
- Amoniac phản ứng với ion H+: Amoniac hấp thụ ion H+ từ axit clohydric để tạo thành ion amoni. Phương trình phản ứng Amoniac : NH3 + H+ ⇌ NH4+
- Tạo thành muối amoni clorua: Ion amoni (NH4+) kết hợp với ion clorua (Cl-) để tạo thành muối amoni clorua. Phương trình tạo muối: NH4+ + Cl- ⇌ NH4Cl
Phản ứng chuyển đổi NH3 thành NH4Cl là phản ứng axit-bazơ, trong đó NH3 đóng vai trò là bazơ và HCl đóng vai trò là axit. Phản ứng xảy ra do sự hấp thụ ion H+ từ axit clohydric bởi amoniac, tạo thành ion amoni và ion clorua, sau đó kết hợp với nhau để tạo thành muối amoni clorua.
Hiện tượng khói trắng khi NH3 tác dụng với HCl là do đâu?

Hiện tượng khói trắng khi NH3 tác dụng với HCl là do sự kết hợp của hai yếu tố chính:
- Sự hình thành các hạt nhỏ: Khi NH3 phản ứng với HCl, muối amoni clorua (NH4Cl) được tạo thành. NH4Cl có xu hướng tạo thành các hạt nhỏ li ti, bao gồm các phân tử NH3 và HCl liên kết với nhau. Những hạt nhỏ này có kích thước siêu nhỏ, chỉ khoảng vài micromet.
- Sự bay hơi: NH4Cl có nhiệt độ sôi thấp hơn nhiệt độ phòng (khoảng 338°C). Do đó, khi được tạo thành, NH4Cl nhanh chóng chuyển từ trạng thái rắn sang trạng thái khí, bay hơi vào không khí. Quá trình bay hơi này diễn ra nhanh chóng và tạo ra một lượng lớn hơi nước.
Sự kết hợp của hai yếu tố trên dẫn đến sự xuất hiện của “khói trắng” của phản ứng giữa NH3 và HCl. Hơi nước từ NH4Cl bay hơi kết hợp với các hạt NH4Cl nhỏ li ti tạo thành một hệ thống phân tán, tán xạ ánh sáng, khiến chúng ta nhìn thấy “khói” màu trắng.
Ngoài ra, một số yếu tố khác cũng góp phần vào hiện tượng phản ứng giữa NH3 và HCl:
- Chênh lệch áp suất: Khi NH3 và HCl được trộn với nhau, áp suất trong bình chứa tăng lên, đẩy nhanh quá trình bay hơi của NH4Cl.
- Độ ẩm: Độ ẩm cao trong môi trường cũng có thể làm tăng khả năng nhìn thấy “khói” trắng.
Như vậy, hiện tượng khói trắng khi NH3 tác dụng với HCl là kết quả của sự hình thành các hạt NH4Cl nhỏ li ti kết hợp với quá trình bay hơi nhanh chóng của NH4Cl. Hiện tượng này có thể quan sát được do sự tán xạ ánh sáng của các hạt NH4Cl trong hệ thống phân tán.
Tính chất hoá học của NH3
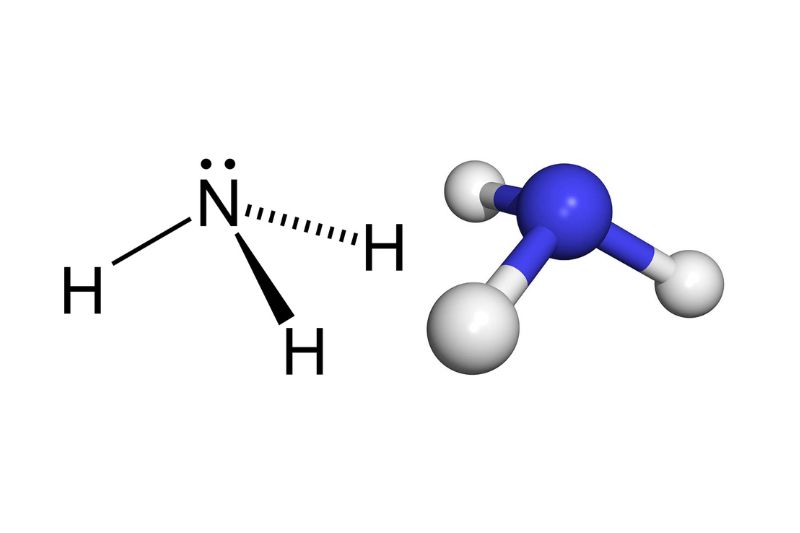
Amoniac có tính bazơ yếu
Amoniac phản ứng với nước
- NH3 + H2O ⇔ NH4+ + OH-
Amoniac phản ứng với Axit tạo thành muối amoni
- NH3 (khí) + HCl (khí) → NH4Cl (khói trắng)
Amoniac tác dụng với dung dịch muối không tan tạo thành bazơ và muối
- NH3 + Muối (dung dịch) → Bazơ + Muối mới
Ví dụ: 2NH3+ MgCl2 + 2H2O → Mg(OH)2 + 2NH4Cl
- Với muối của Cu2+, Ag+ và Zn2+ như: Cu(NH3)4(OH)2; Ag(NH3)2OH; Zn(NH3)4(OH)2 khi tác dụng với Amoniac sẽ có kết tủa nhưng sau đó kết tủa tan do tạo phức chất tan.
Ví dụ: ZnSO4+ 2NH3+ 2H2O → Zn(OH)2↓ + (NH4)2SO4
Amoniac có tính khử mạnh
Nguyên nhân amoniac có tính khử mạnh là bởi vì trong NH3 có nguyên tử N với mức oxi hóa thấp nhất -3.
Amoniac tác dụng với O2
- 4NH3 + 3O2 →2N2↑ + 6H2O (điều kiện thường t0)
- 4NH3 + 5O2 → 4NO↑ + 6H2O (điều kiện 800 độ C, Pt)
Amoniac tác dụng với Cl2
- 2NH3 + 3Cl2 → N2↑ + 6HCl (điều kiện thường t0)
Amoniac tác dụng với oxit của kim loại
- 3CuO + 2NH3 → Cu + 3H2O + N2 (điều kiện thường t0)
Khả năng tạo phức
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức.
Dung dịch amoniac với Cu(OH)2
- Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
Dung dịch amoniac với AgCl
- AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự hình thành các ion phức là do sự kết hợp của các phân tử NH3 với các electron chưa sử dụng của nguyên tử nitơ và các ion kim loại.
Ứng dụng của NH4Cl

Lý do điều chế NH3 ra NH4Cl là để ứng dụng trong các lĩnh vực công nghiệp và cả y học. Vì vậy, ở dưới đây sẽ là những công dụng thực thế của hợp chất NH4Cl mà bạn có thể bắt gặp trong đời sống hằng ngày
Trong sản xuất phân bón
NH4Cl có công dụng chính và quan trọng nhất trong ngành nông nghiệp vì nó cung cấp nitơ để sản xuất phân bón. Nguồn nitơ của ứng dụng này chiếm 90% sản lượng amoni clorua của thế giới. Những loại cây chứa nguồn nitơ này là: Lúa ở châu Á, lúa mì, rau, cây gai dầu,..
Trong công nghiệp thực phẩm
Amoni clorua hoặc sal amoniac còn được sử dụng làm phụ gia thực phẩm. Trong nấm men dùng để nướng bánh mì cũng có chứa Amoni để tăng lượng dinh dưỡng của nấm. Ngoài ra nó còn được sử dụng như một chất làm tăng vị ngọt cho cam thảo và là hương liệu trong Salmiakki Koskenkorva Vodka.
Trong công nghiệp luyện kim
NH4Cl được dùng để làm sạch bề mặt phôi bằng cách cho tác dụng với các oxit kim loại để để tạo ra chất oxy hóa như Cl2 (clo) hoặc ClO2 (clo dioxide). Chúng có thể được sử dụng để xử lý và loại bỏ các chất cặn gỉ và oxi hóa từ bề mặt kim loại. Ngoài ra, nó còn được sử dụng làm chất điện phân trong pin kẽm-carbon.
=>> Có thể bạn cũng quan tâm về Phương trình phản ứng nhiệt phân NH4Cl ra NH3: NH4Cl → NH3 + HCl (t°)
Kết luận
Như vậy, Phương trình chuyển đổi NH3 ra NH4Cl sẽ được thể hiện qua phương trình “NH3 + HCl → NH4Cl”. Phản ứng này xảy ra một cách nhanh chóng và hoàn toàn ở điều kiện nhiệt độ phòng. Và sản phẩm thu được sẽ là NH4Cl, một loại muối có nhiều ứng dụng trong đời sống của chúng ta. Hy vọng qua bài viết trên, mình đã giúp bạn hiểu rõ hơn về Phương trình chuyển đổi NH3 ra NH4Cl. Hãy luôn theo dõi mình để đọc thêm nhiều bài viết hữu ích khác nhé.